Teori asam basa menurut lewis adalah.
Jika kamu sedang mencari artikel teori asam basa menurut lewis adalah terbaru, berarti kamu sudah berada di website yang benar. Yuk langsung saja kita simak pembahasan teori asam basa menurut lewis adalah berikut ini.
 Pengertian Asam Basa Teori Penggolongan Dan Contohnya Ilmu Kimia From pakarkimia.com
Pengertian Asam Basa Teori Penggolongan Dan Contohnya Ilmu Kimia From pakarkimia.com
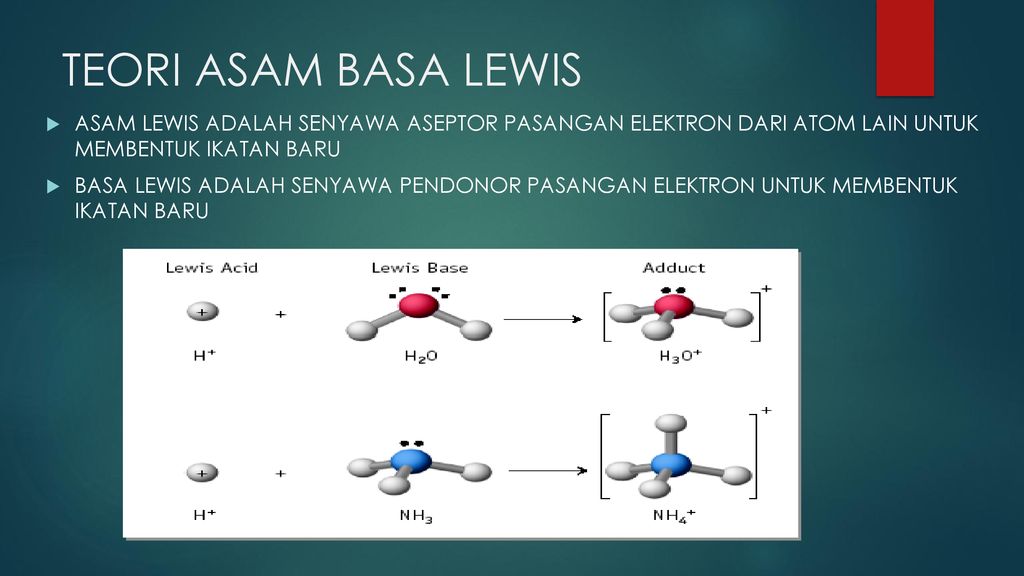
Keunggulan teori asam-basa Lewis adalah menggambarkan asam-basa yang tidak dapat digambarkan oleh Arrhenius dan Bronsted-Lowry. CH3COOH H2O H3O CH3COO-Reaksi diatas adalah rekasi reversible dimana reaktan dapat membentuk produk sementra produk juga seketika dpat membentuk reaktan. Contoh beberapa asam Lewis adalah SO 3 BF 3 maupun AlF 3. Spesi yang menerima PEB ini disebut asam Lewis.
Basa Lewis yang memberikan PEB kepada atom pusat spesi bisa molekul atau ion lain yang sanggup menerima PEB itu.
Hormon pada tumbuhan dan fungsinya. Syarat atom dalam molekulion dapat menerima PEB harus memiliki orbital kosong untuk menampung PEB tersebut. Teorinya menjelaskan tentang asam dan basa berdasarkan struktur dan ikatan. Teori asam-basa Lewis memperluas pengertian asam-basa. Asam adalah spesi yang menerima pasangan elektron bebas non ikatan atau akseptor pasangan elektron non ikatan.
 Source: teamhannamy.blogspot.com
Source: teamhannamy.blogspot.com
Basa Lewis yang memberikan PEB kepada atom pusat spesi bisa molekul atau ion lain yang sanggup menerima PEB itu. Lalu didalam Teori Asam Basa menurut Lewis ini bahwa Asam merupakan suatu Senyawa Kimia Zat yang bisa menerima Pasangan Elektron dari Senyawa Zat lain atau bisa dikatakan Akseptor pasangan Elektron sedangkan Basa Menurut Teori Asam Basa Lewis ialah suatu Senyawa Kimia Zat yang bisa memberikan pasangan Elektron kepada Senyawa yang lain atau bisa dikatakan sebagai. Syarat atom dalam molekulion dapat menerima PEB harus memiliki orbital kosong untuk menampung PEB tersebut. Hormon pada tumbuhan dan fungsinya. Dasar teori asam-basa Lewis adalah transfer pasangan elektron bebas PEB.
Dasar teori asam-basa Lewis adalah transfer pasangan elektron bebas PEB.
Asas pembangunan pemerintah Orde Baru. Asam menurut Lewis adalah suatu zat yang mempunyai kecenderungan menerima pasangan electron dari basa. Asam adalah spesi yang menerima pasangan elektron bebas non ikatan atau akseptor pasangan elektron non ikatan. Basa Lewis yang memberikan PEB kepada atom pusat spesi bisa molekul atau ion lain yang sanggup menerima PEB itu.
 Source: pakarkimia.com
Source: pakarkimia.com
Teorinya menjelaskan tentang asam dan basa berdasarkan struktur dan ikatan. Basa Lewis yang memberikan PEB kepada atom pusat spesi bisa molekul atau ion lain yang sanggup menerima PEB itu. Asas pembangunan pemerintah Orde Baru. Asam menurut Lewis adalah suatu zat yang mempunyai kecenderungan menerima pasangan electron dari basa.
 Source: slidetodoc.com
Source: slidetodoc.com
Basa Lewis yang memberikan PEB kepada atom pusat spesi bisa molekul atau ion lain yang sanggup menerima PEB itu. Keistimewaan dari teori asam basa bronsted lowry adalah dapat menjelaskan sifat asam basa pada reaksi reversible seperti yang terjadi pada ionisasi asam lemah CH3COOH. Asas pembangunan pemerintah Orde Baru. Asam menurut Lewis adalah suatu zat yang mempunyai kecenderungan menerima pasangan electron dari basa.
 Source: slideshare.net
Source: slideshare.net
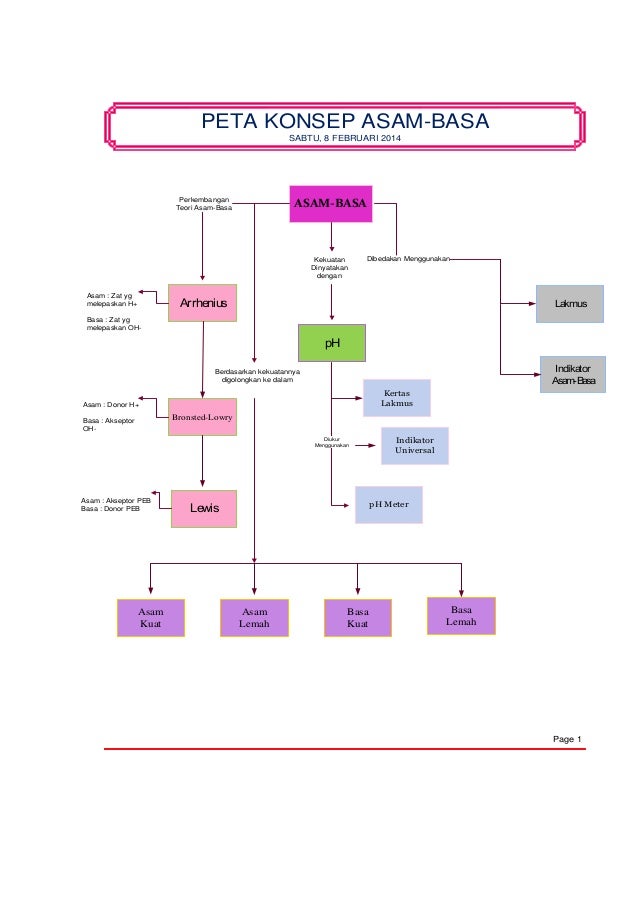
Secara singkat dapat dikatakan bahwa keterbatasan teori Arrhenius adalah bahwa reaksi asam basa hanyalah sebatas pada larutan berair aqueus aq dan asam-basa adalah zat yang hanya menghasilkan H dan OH-. Keistimewaan dari teori asam basa bronsted lowry adalah dapat menjelaskan sifat asam basa pada reaksi reversible seperti yang terjadi pada ionisasi asam lemah CH3COOH. Sedangkan basa menurut Lewis adalah zat yang dapat memberikan pasangan elektron. TEORI ASAM BASA BRONSTED-LOWRY Pada tahun 1923 Johannes Bronsted Denmark dan Thomas Lowry Inggris.
Sedangkan basa menurut Lewis adalah zat yang dapat memberikan pasangan elektron. Asam menurut Lewis adalah suatu zat yang mempunyai kecenderungan menerima pasangan electron dari basa. Secara singkat dapat dikatakan bahwa keterbatasan teori Arrhenius adalah bahwa reaksi asam basa hanyalah sebatas pada larutan berair aqueus aq dan asam-basa adalah zat yang hanya menghasilkan H dan OH-. Spesi yang menerima PEB ini disebut asam Lewis.
Teorinya menjelaskan tentang asam dan basa berdasarkan struktur dan ikatan.
Sedangkan basa menurut Lewis adalah zat yang dapat memberikan pasangan elektron. Asas pembangunan pemerintah Orde Baru. Asam menurut Lewis adalah suatu zat yang mempunyai kecenderungan menerima pasangan electron dari basa. Contoh gangguan pada sistem peredaran darah. TEORI ASAM BASA BRONSTED-LOWRY Pada tahun 1923 Johannes Bronsted Denmark dan Thomas Lowry Inggris.
 Source: slideplayer.info
Source: slideplayer.info
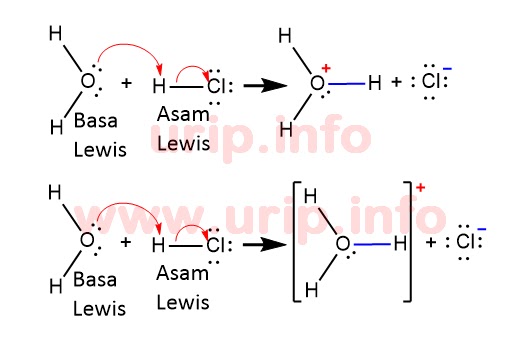
Menurut Lewis asam-basa bukan hanya pelepasan ion H atau OH atau transfer proton ion H melainkan senyawa yang reaksinya melibatkan pasangan elektron. Contoh beberapa asam Lewis adalah SO 3 BF 3 maupun AlF 3. Asam menurut Lewis adalah suatu zat yang mempunyai kecenderungan menerima pasangan electron dari basa. Spesi yang menerima PEB ini disebut asam Lewis. CH3COOH H2O H3O CH3COO-Reaksi diatas adalah rekasi reversible dimana reaktan dapat membentuk produk sementra produk juga seketika dpat membentuk reaktan.
Keunggulan teori asam-basa Lewis adalah menggambarkan asam-basa yang tidak dapat digambarkan oleh Arrhenius dan Bronsted-Lowry. Basa Lewis yang memberikan PEB kepada atom pusat spesi bisa molekul atau ion lain yang sanggup menerima PEB itu. CH3COOH H2O H3O CH3COO-Reaksi diatas adalah rekasi reversible dimana reaktan dapat membentuk produk sementra produk juga seketika dpat membentuk reaktan. TEORI ASAM BASA BRONSTED-LOWRY Pada tahun 1923 Johannes Bronsted Denmark dan Thomas Lowry Inggris.
Pengertian Asam Dan Basa Menurut Teori Lewis Berikut ini adalah pengertian asam dan basa menurut teori Lewis.
Lalu didalam Teori Asam Basa menurut Lewis ini bahwa Asam merupakan suatu Senyawa Kimia Zat yang bisa menerima Pasangan Elektron dari Senyawa Zat lain atau bisa dikatakan Akseptor pasangan Elektron sedangkan Basa Menurut Teori Asam Basa Lewis ialah suatu Senyawa Kimia Zat yang bisa memberikan pasangan Elektron kepada Senyawa yang lain atau bisa dikatakan sebagai. Menurut Lewis asam-basa bukan hanya pelepasan ion H atau OH atau transfer proton ion H melainkan senyawa yang reaksinya melibatkan pasangan elektron. TEORI ASAM BASA BRONSTED-LOWRY Pada tahun 1923 Johannes Bronsted Denmark dan Thomas Lowry Inggris. Teori asam-basa Lewis memperluas pengertian asam-basa.
 Source: kimia-science7.com
Source: kimia-science7.com
Contoh beberapa asam Lewis adalah SO 3 BF 3 maupun AlF 3. TEORI ASAM BASA BRONSTED-LOWRY Pada tahun 1923 Johannes Bronsted Denmark dan Thomas Lowry Inggris. Contoh beberapa asam Lewis adalah SO 3 BF 3 maupun AlF 3. Secara singkat dapat dikatakan bahwa keterbatasan teori Arrhenius adalah bahwa reaksi asam basa hanyalah sebatas pada larutan berair aqueus aq dan asam-basa adalah zat yang hanya menghasilkan H dan OH-.
 Source: slideplayer.info
Source: slideplayer.info
Menurut Lewis asam-basa bukan hanya pelepasan ion H atau OH atau transfer proton ion H melainkan senyawa yang reaksinya melibatkan pasangan elektron. Contoh beberapa asam Lewis adalah SO 3 BF 3 maupun AlF 3. Spesi yang menerima PEB ini disebut asam Lewis. Basa adalah spesi yang mendonorkan pasangan elektron bebas atau donor pasangan elektron non ikatan.
 Source: slidetodoc.com
Source: slidetodoc.com
Keunggulan teori asam-basa Lewis adalah menggambarkan asam-basa yang tidak dapat digambarkan oleh Arrhenius dan Bronsted-Lowry. TEORI ASAM BASA BRONSTED-LOWRY Pada tahun 1923 Johannes Bronsted Denmark dan Thomas Lowry Inggris. Lalu didalam Teori Asam Basa menurut Lewis ini bahwa Asam merupakan suatu Senyawa Kimia Zat yang bisa menerima Pasangan Elektron dari Senyawa Zat lain atau bisa dikatakan Akseptor pasangan Elektron sedangkan Basa Menurut Teori Asam Basa Lewis ialah suatu Senyawa Kimia Zat yang bisa memberikan pasangan Elektron kepada Senyawa yang lain atau bisa dikatakan sebagai. Syarat atom dalam molekulion dapat menerima PEB harus memiliki orbital kosong untuk menampung PEB tersebut.
TEORI ASAM BASA BRONSTED-LOWRY Pada tahun 1923 Johannes Bronsted Denmark dan Thomas Lowry Inggris.
Basa Lewis yang memberikan PEB kepada atom pusat spesi bisa molekul atau ion lain yang sanggup menerima PEB itu. Asam menurut Lewis adalah suatu zat yang mempunyai kecenderungan menerima pasangan electron dari basa. Keistimewaan dari teori asam basa bronsted lowry adalah dapat menjelaskan sifat asam basa pada reaksi reversible seperti yang terjadi pada ionisasi asam lemah CH3COOH. Pengertian Asam Dan Basa Menurut Teori Lewis Berikut ini adalah pengertian asam dan basa menurut teori Lewis. Dasar teori asam-basa Lewis adalah transfer pasangan elektron bebas PEB.
 Source: brainly.co.id
Source: brainly.co.id
Asam adalah spesi yang menerima pasangan elektron bebas non ikatan atau akseptor pasangan elektron non ikatan. Secara singkat dapat dikatakan bahwa keterbatasan teori Arrhenius adalah bahwa reaksi asam basa hanyalah sebatas pada larutan berair aqueus aq dan asam-basa adalah zat yang hanya menghasilkan H dan OH-. Dasar teori asam-basa Lewis adalah transfer pasangan elektron bebas PEB. Teori asam-basa Lewis memperluas pengertian asam-basa. Hormon pada tumbuhan dan fungsinya.
Basa adalah spesi yang mendonorkan pasangan elektron bebas atau donor pasangan elektron non ikatan.
Asam adalah spesi yang menerima pasangan elektron bebas non ikatan atau akseptor pasangan elektron non ikatan. Dasar teori asam-basa Lewis adalah transfer pasangan elektron bebas PEB. Syarat atom dalam molekulion dapat menerima PEB harus memiliki orbital kosong untuk menampung PEB tersebut. Hormon pada tumbuhan dan fungsinya.
 Source: slideshare.net
Source: slideshare.net
Dasar teori asam-basa Lewis adalah transfer pasangan elektron bebas PEB. Lalu didalam Teori Asam Basa menurut Lewis ini bahwa Asam merupakan suatu Senyawa Kimia Zat yang bisa menerima Pasangan Elektron dari Senyawa Zat lain atau bisa dikatakan Akseptor pasangan Elektron sedangkan Basa Menurut Teori Asam Basa Lewis ialah suatu Senyawa Kimia Zat yang bisa memberikan pasangan Elektron kepada Senyawa yang lain atau bisa dikatakan sebagai. Spesi yang menerima PEB ini disebut asam Lewis. Contoh gangguan pada sistem peredaran darah.
 Source: brainly.co.id
Source: brainly.co.id
Hormon pada tumbuhan dan fungsinya. Spesi yang menerima PEB ini disebut asam Lewis. Keunggulan teori asam-basa Lewis adalah menggambarkan asam-basa yang tidak dapat digambarkan oleh Arrhenius dan Bronsted-Lowry. Asam menurut Lewis adalah suatu zat yang mempunyai kecenderungan menerima pasangan electron dari basa.
 Source: slideshare.net
Source: slideshare.net
Basa adalah spesi yang mendonorkan pasangan elektron bebas atau donor pasangan elektron non ikatan. Asam menurut Lewis adalah suatu zat yang mempunyai kecenderungan menerima pasangan electron dari basa. Dasar teori asam-basa Lewis adalah transfer pasangan elektron bebas PEB. Asam adalah spesi yang menerima pasangan elektron bebas non ikatan atau akseptor pasangan elektron non ikatan.
Spesi yang menerima PEB ini disebut asam Lewis.
Basa Lewis yang memberikan PEB kepada atom pusat spesi bisa molekul atau ion lain yang sanggup menerima PEB itu. Syarat atom dalam molekulion dapat menerima PEB harus memiliki orbital kosong untuk menampung PEB tersebut. Spesi yang menerima PEB ini disebut asam Lewis. Contoh beberapa asam Lewis adalah SO 3 BF 3 maupun AlF 3. Sedangkan basa menurut Lewis adalah zat yang dapat memberikan pasangan elektron.
 Source: urip.info
Source: urip.info
Pengertian Asam Dan Basa Menurut Teori Lewis Berikut ini adalah pengertian asam dan basa menurut teori Lewis. Spesi yang menerima PEB ini disebut asam Lewis. Syarat atom dalam molekulion dapat menerima PEB harus memiliki orbital kosong untuk menampung PEB tersebut. Keunggulan teori asam-basa Lewis adalah menggambarkan asam-basa yang tidak dapat digambarkan oleh Arrhenius dan Bronsted-Lowry. Asam menurut Lewis adalah suatu zat yang mempunyai kecenderungan menerima pasangan electron dari basa.
CH3COOH H2O H3O CH3COO-Reaksi diatas adalah rekasi reversible dimana reaktan dapat membentuk produk sementra produk juga seketika dpat membentuk reaktan.
Contoh beberapa asam Lewis adalah SO 3 BF 3 maupun AlF 3. Pengertian Asam Dan Basa Menurut Teori Lewis Berikut ini adalah pengertian asam dan basa menurut teori Lewis. Teorinya menjelaskan tentang asam dan basa berdasarkan struktur dan ikatan. TEORI ASAM BASA BRONSTED-LOWRY Pada tahun 1923 Johannes Bronsted Denmark dan Thomas Lowry Inggris.
 Source: gurupengajar.com
Source: gurupengajar.com
Spesi yang menerima PEB ini disebut asam Lewis. Asas pembangunan pemerintah Orde Baru. Pengertian Asam Dan Basa Menurut Teori Lewis Berikut ini adalah pengertian asam dan basa menurut teori Lewis. Teorinya menjelaskan tentang asam dan basa berdasarkan struktur dan ikatan. Basa Lewis yang memberikan PEB kepada atom pusat spesi bisa molekul atau ion lain yang sanggup menerima PEB itu.
 Source: kimia-science7.com
Source: kimia-science7.com
Dasar teori asam-basa Lewis adalah transfer pasangan elektron bebas PEB. TEORI ASAM BASA BRONSTED-LOWRY Pada tahun 1923 Johannes Bronsted Denmark dan Thomas Lowry Inggris. Secara singkat dapat dikatakan bahwa keterbatasan teori Arrhenius adalah bahwa reaksi asam basa hanyalah sebatas pada larutan berair aqueus aq dan asam-basa adalah zat yang hanya menghasilkan H dan OH-. CH3COOH H2O H3O CH3COO-Reaksi diatas adalah rekasi reversible dimana reaktan dapat membentuk produk sementra produk juga seketika dpat membentuk reaktan. Sedangkan basa menurut Lewis adalah zat yang dapat memberikan pasangan elektron.
 Source: pt.slideshare.net
Source: pt.slideshare.net
Pengertian Asam Dan Basa Menurut Teori Lewis Berikut ini adalah pengertian asam dan basa menurut teori Lewis. Teori asam-basa Lewis memperluas pengertian asam-basa. Keunggulan teori asam-basa Lewis adalah menggambarkan asam-basa yang tidak dapat digambarkan oleh Arrhenius dan Bronsted-Lowry. Dasar teori asam-basa Lewis adalah transfer pasangan elektron bebas PEB. Secara singkat dapat dikatakan bahwa keterbatasan teori Arrhenius adalah bahwa reaksi asam basa hanyalah sebatas pada larutan berair aqueus aq dan asam-basa adalah zat yang hanya menghasilkan H dan OH-.
Situs ini adalah komunitas terbuka bagi pengguna untuk berbagi apa yang mereka cari di internet, semua konten atau gambar di situs web ini hanya untuk penggunaan pribadi, sangat dilarang untuk menggunakan artikel ini untuk tujuan komersial, jika Anda adalah penulisnya dan menemukan gambar ini dibagikan tanpa izin Anda, silakan ajukan laporan DMCA kepada Kami.
Jika Anda menemukan situs ini baik, tolong dukung kami dengan membagikan postingan ini ke akun media sosial seperti Facebook, Instagram dan sebagainya atau bisa juga simpan halaman blog ini dengan judul teori asam basa menurut lewis adalah dengan menggunakan Ctrl + D untuk perangkat laptop dengan sistem operasi Windows atau Command + D untuk laptop dengan sistem operasi Apple. Jika Anda menggunakan smartphone, Anda juga dapat menggunakan menu laci dari browser yang Anda gunakan. Baik itu sistem operasi Windows, Mac, iOS, atau Android, Anda tetap dapat menandai situs web ini.





